三个最受关注的COVID-19疫苗临床试验结果分别上线。
中国的Ad5疫苗载体疫苗的2期临床试验和英国的AZD1222(之前称为ChAdOx1)的1/2期临床试验分别发表在了Lancet杂志
而美国和德国合作的mRNA疫苗BNT162b1的1/2期临床试验部分结果上传到了预印本medRxiv。
Ad5腺病毒载体疫苗由中国军事医学科学院和CanSina研发,Lancet报道了在武汉进行的单中心2期RCT临床试验结果,是对之前1期研究结果的扩展。
该2期试验508人受试,3组分别接种10e11 VP(n=253),5e10 VP(n=129)或安慰剂(n=126)。
结合抗体:
接种后28天,10e11和5e10 VP组血清抗体阳性率分别为96%和97%,并产生了高滴度RBD IgG。
中和抗体:
两组均产生了中和抗体GMT分别为19.5和18.3。
T细胞免疫应答:
90%的10e11 VP组产生了特异性IFN-g,88%的5e10 VP组产生了特异性IFN-g,提示该疫苗诱导了T细胞应答。
不良反应:
10e11 VP组不良事件发生率为72%,9%受试者发生3级不良反应;5e10 VP组不良事件发生率为74%,1%受试者发生3级不良反应。无严重不良事件(SAE)发生。
结论:
研究提示5e10 VP不良反应相对轻微,且该剂量可诱导有效的免疫反应。

(Ad5腺病毒疫苗主要结果)
AZD1222腺病毒载体疫苗由牛津大学和阿斯利康公司开发,之前称为ChAdOx1,该疫苗临床试验在4月23日至5月21日共招募了1077个受试者。
543人接种了ChAdOx1-nCoV-19,543对照组接种了脑膜炎共价疫苗MenACWY,另外10人进行了非随机的ChAdOx1 -nCoV-19初免-加强试验。
不良反应:
研究发现ChAdOx1-nCoV-19受试者出现局部和全身不良反应并不鲜见,非甾体解热镇痛药可以缓解发热、肌痛、头痛等症状。ChAdOx1-nCoV-19组没有严重不良反应发生。
T细胞免疫应答:
ChAdOx1-nCoV-19接种后14天特异性T应答达到峰值(ELISPOT 856/10e6 PBMC)。
结合抗体:
接种后28天内,抗体滴度持续上升(157 EU),并在之后的加强接种后继续上升(639 EU)。
中和抗体:
研究对35名受试者进行血清中和检测,如果应用MNA80法检测,91%在单次接种后具有血清中和反应,而应用PRNT50则100%具有血清中和反应。在加强接种后,所有被检测的受试者均有血清中和反应。
血清中和和IgG滴度呈正相关。
结论:
这一结果显示ChAdOx1-nCoV-19具有可接受的安全性,并能诱导一定抗体和T细胞应答,因此可以进行3期临床试验。

(ChAdOx1腺病毒主要结果)
BNT162b1mRNA疫苗由BioNTech将辉瑞诱导的T细胞应答的文章上传到了medRxiv,由此可以比较该疫苗诱导T细胞应答的水平。之前该疫苗的抗体和血清中和结果已上传到了medRxiv。
BNT162b1是一种脂质纳米颗粒制剂的mRNA疫苗,mRNA编码抗原为RBD。在这个BNT162b1的1/2期open label试验中,该疫苗也可诱导T细胞应答。
T细胞免疫应答:
本研究发现2次接种1 - 50ug BNT162b1可以诱导强烈的CD4和CD8 T疫苗免疫及抗体应答。
结合抗体:
RBD IgG滴度高于COVID-19康复者(HCS)血清。
中和抗体:
第1次接种后43天,50ug组血清中和活性为HCS的3.5倍。
该疫苗诱导的中和血清具有广谱性,可中和多个SARS-CoV-2假病毒毒株;该疫苗诱导了有效的Th1 CD4 T细胞免疫,CD4和CD8 T细胞反应具有RBD特异性。
结论:
这项研究补充了之前BNT162b1疫苗的抗体数据,并指出了mRNA疫苗可同时诱导有效的抗体反应和T细胞应答。

(BNT162b1mRNA疫苗主要结果)
Hanson解读:
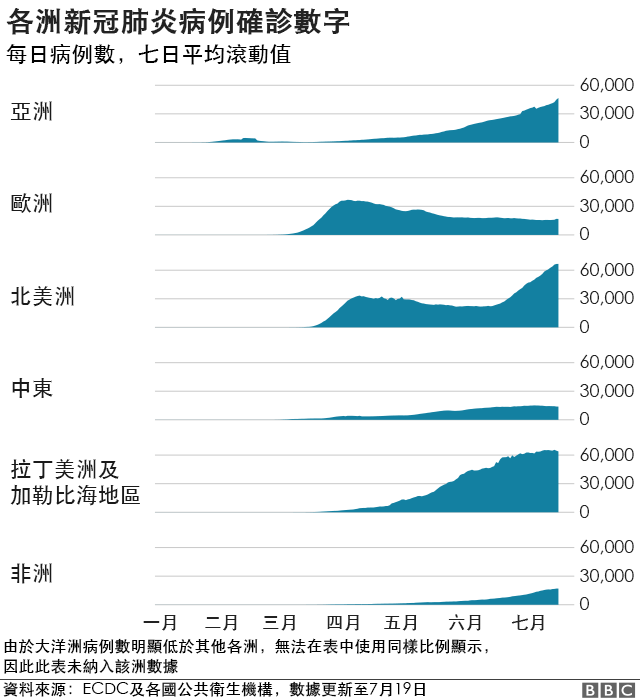
结合上周美国Moderna公司发表于新英格兰医学杂志的mRNA1273疫苗1期临床试验结果,目前已经有2个mRNA疫苗,2个腺病毒载体疫苗的1期或者2期临床试验结果发表;均显示可靠的预防效果和安全性。
相对比,目前公布的两个腺病毒载体疫苗诱导的血清中和活性比Moderna和辉瑞的mRNA疫苗诱导的血清中和活性要低;而腺病毒载体疫苗的一个优势是诱导更高效的T细胞免疫应答。
另外需要注意的是,人群中部分人对腺病毒有中和抗体,可能会影响人腺病毒载体疫苗(Ad5)的疫苗预防效果;AZD1222是非人腺病毒载体疫苗,也可能由于存在交叉反应而影响效果。
在目前世界新冠疫情无法得到有效控制、且治疗药物效果不佳的情况下,疫苗成为人类最后的希望。
但是也需要清醒地看到,目前得到的只是1期或者2期临床试验结果,也就是受试者体内出现了结合抗体和中和抗体。最终预防效果,仍需要继续通过3期临床试验来验证。
附:目前进入到2期临床试验的疫苗一览表
(目前领先的部分疫苗)
一览表说明:
目前特批疫苗一个,CanSina/中国军科院的Ad5-nCoV;
进入到3期的三个,除了中国的两个,英国阿斯利康/牛津大学的分布在英国进行2/3期临床试验,同时在巴西进行3期临床试验;
进入到2期的十个,其中强生公司的为7月20日新补充。
用黄色加亮的标示被美国政府纳入到Warp Speed并得到资助的项目;
绿色下划线标示获得美国FDA快速通道。
相关报道:多国新冠疫苗研发传重磅喜讯,结果显示积极
据美国侨报报道 新冠疫苗研发情况再传重磅消息。20日,国际学术期刊《柳叶刀》杂志在线发表中国工程院院士陈薇团队研发的新冠疫苗II期临床试验结果论文,显示安全并可诱发免疫反应。此外,当日牛津大学研发的冠状病毒疫苗早期结果也在该期刊发表,显示该疫苗在大规模早期人体试验中产生良好免疫反应。目前,全球已有23种疫苗进入临床试验阶段,多国科学团队加快研发速度,竞争激烈。

清华大学检测6项病毒的核酸检测芯片试剂盒获批。(图片来源:中新社资料图)
陈薇团队疫苗试验安全可诱发免疫
根据《柳叶刀》20日发表的最新论文显示,由中国工程院院士、军事科学院军事医学研究院研究员陈薇领衔团队研发的重组新冠疫苗II期临床试验安全,并且可以诱发免疫反应。
根据该论文介绍,陈薇团队开展的II期临床试验中,有超过500名志愿者参与,其中包括55岁以上人士,与I期临床试验相比参与者的范围更大。试验目的是评估这种疫苗能否诱导人体产生免疫应答以及是否有足够的安全性,结果显示疫苗在这两方面都产生了很好的结果。
参与该试验的研究人员表示,II期临床试验与I期临床试验相比,为疫苗在更大范围人群中的安全性和免疫原性提供了进一步的证据,这是评估候选疫苗的“重要一步”,团队目前正在开展III期临床试验。
不过该研究人员也指出,参与试验的志愿者并没有在接种疫苗后接触新冠病毒,因此还无法基于这项试验结果来判断疫苗能否有效保护人们免于感染新冠病毒,还需要III期临床试验来进一步验证。
陈薇领衔团队研发的重组新冠疫苗进展备受世界关注,在I期临床试验纳入108名受试者后,4月12日进入II期随机双盲、安慰剂对照临床试验,这也是当时全球唯一进入II期临床试验的新冠疫苗。
多国疫苗试验结果显示积极
与中国疫苗研发同时曝出好消息的还有牛津大学疫苗研究进展。《柳叶刀》20日发布牛津大学研发的一种可能的冠状病毒疫苗在大规模早期人体试验中产生了良好的免疫反应。
这款疫苗由牛津大学研究人员与英国制药巨头阿斯利康(AstraZeneca)合作,疫苗被称为AZD1222,是一种重组腺病毒疫苗。实验共有1000多人参与。
该疫苗试验显示,在此次参与的所有受试者中,疫苗AZD1222均被耐受,并产生了“剧烈的免疫反应”。研究人员称,这种疫苗同时产生抗体和杀伤T细胞来对抗感染。28天后,在参与者体内检测到中和抗体,而科学家们认为中和抗体对于人体获得对病毒的保护来说是非常重要的。
牛津大学詹纳研究所所长希尔(Adrian Hill)教授表示,剧烈的免疫反应意味着疫苗更有可能为人体提供针对新冠病毒的保护。希尔还称,科学家们希望在未来几周内开始在美国进行人体试验。
此外,20日,美国制药巨头辉瑞和德国生物科技公司Biontech也宣布新冠肺炎疫苗研究取得早期的积极进展。而俄罗斯新冠疫苗当日宣称研究取得新进展,临床试验结果显示所有接种疫苗的志愿者都产生了免疫反应。
疫苗研发竞争激烈世卫吁公平分配疫苗
截至7月15日的世卫组织数据显示,全球已经有23种新冠病毒疫苗进入临床试验阶段,此外还有140种疫苗在临床前研究阶段。
20日,世卫组织针对《柳叶刀》杂志发文显示中英两国的两种疫苗均在临床试验中显示对人体安全并可引发强烈的免疫反应表示祝贺。不过,世卫组织卫生紧急项目负责人瑞安同时指出,在这一积极结果的基础上,还有很长的路要走,需要进行更大规模的试验。
目前,世界各国疫苗研发速度加快,竞争激烈。有消息称,中国国产新冠病毒灭活疫苗最快于今年底明年初上市。但中国疾控中心免疫规划首席专家王华庆7月17日分析称,新冠疫苗上市之初的市场供应可能较紧张。
世卫组织总干事谭德塞20日称,除了加速研发疫苗及治疗方法,还应向可能负担不起疫苗的人们提供公平获取疫苗的渠道,世卫组织已制定了分配框架,正在进行最终定稿。为了实现公平分配,尤其是贫困人口能够获得疫苗,最重要的因素是政治承诺,这是实现疫苗公平分配的唯一途径。
延伸阅读:肺炎疫情:英中两项新冠疫苗试验获重大进展

7月20日,英国与中国两支新冠肺炎疫苗研发团队分别表示他们的试验出现积极进展,给疫苗早日问世带来了一些希望。
两个团队分别为英国牛津大学团队及中国工程院院士陈薇团队。牛津大学疫苗试验已在所有接受试验的人身上产生免疫反应,且没有出现令人担忧的副作用。陈薇团队疫苗也显示出安全性,且绝大多数志愿者出现免疫反应。
这些发现虽然十分振奋人心,但目前判断它们是否足够帮助人类预防新冠病毒仍然为时尚早,这些团队也需要进行更大范围试验。
牛津大学疫苗

牛津大学与英国药厂阿斯利康(AstraZeneca)共同研发的疫苗名为“ChAdOx1 nCoV-19”,这个项目进展超出预期。
科学家们将一种可以导致黑猩猩感冒的病毒进行基因工程改造,使其不会致人传染,并“看”上去更像新冠病毒,从而可以让免疫系统学习如何攻击新冠病毒,产生新冠抗体病应对病毒的T细胞。
目前针对新冠病毒的几乎都聚焦于抗体,但抗体只是人类免疫系统的一部分,T细胞对于免疫同样重要。几乎所有的有效疫苗都会在诱发抗体反应的同时诱发T细胞产生反应。
中和抗体可以使新冠病毒失去效力,而T细胞是一种白细胞,有助于协调免疫系统,可以发现人体内哪些细胞已被感染并摧毁这些细胞。
牛津大学团队发现,在注射疫苗14天后,志愿者体内的T细胞达到峰值,抗体也在注射28天后达到峰值。这项结果于7月20日在世界顶级医学期刊《柳叶刀》(Lancent)上发表,但目前该研究进行时长有限,尚不清楚这些T细胞和抗体会在人体内坚持多久。
该团队成员成员安德鲁·波拉德(Andrew Pollard)教授向BBC表示,非常高兴看到中和抗体与T细胞同时出现。他称这一进展“极其有希望”,但对于所有人想知道的疫苗是否有效及能否为人体提供保护的问题,目前“仍需要时间”。
牛津大学的研究显示,90%的人在接受一次注射后产生中和抗体,其中只有10人接受两次注射,而10人全部产生了中和抗体。
这一疫苗虽然安全,但仍有副作用。70%的人出现发烧或头痛等反应。研究人员称可以通过乙酰氨基酚(paracetamol)控制这些不良反应。
中国团队成果
中国工程院院士陈薇团队的疫苗研发进展也于同一天在《柳叶刀》上发表。该报告称,在508名接种了一剂疫苗的健康志愿者中,显示出安全性,并且大部分志愿者出现免疫反应。
报告指出,单次接种疫苗28天后,99.5%的受试者产生了特异性抗体,95.3%受试者产生了中和抗体,89%的受试者产生了特异性T细胞免疫反应。
另外,约77%的人出现发烧、注射部位疼痛等副作用,但均不严重。
这支疫苗由陈薇团队及康希诺生物公司共同研发。今年6月29日康希诺生物发表公告称,这支疫苗已获批在中国军队内部使用。
陈薇团队与牛津大学团队使用的技术类似,都是用腺病毒为载体,将新冠病毒基因带入人体,引发免疫反应。然而这种策略都仅限于在科学的范畴内进行实践,目前尚未被证实可以得到有效应用。
美国约翰·霍普金斯大学疫苗专家纳尔·巴·泽夫(Naor Bar-Zeev)称,这两项试验十分令人鼓舞,但这些试验前路仍充满未知,也很高兴看到还有采取其他技术的疫苗试验在进行。
其他疫苗试验
目前并非只有牛津大学及陈薇团队的试验进行到这一阶段。美国也有团队发表类似结果。
美国生物技术公司莫德纳(Moderna)是首个实现突破的团队,该公司研发的疫苗可以产生中和抗体。他们向志愿者注射新冠病毒RNA(新冠病毒的遗传密码),通过RNA制造病毒蛋白来触发免疫反应。
德国生物科技公司(BioNTech)和美国制药商辉瑞(Pfizer)的RNA疫苗也取得了积极进展。
另外还有更多团队的传统方式疫苗取得了一些成果。目前全球共有23支疫苗进入临床试验阶段,另有140支疫苗在早期研发阶段。


